En bioquímica, las proteínas juegan un papel fundamental en la vida de todos los seres vivos. Estas biomoléculas son esenciales para una gran variedad de procesos biológicos que sostienen la vida. Veremos de qué están compuestas estas proteínas, su estructura y algunos ejemplos de proteínas que podemos encontrar en la naturaleza y en nuestra propia alimentación.
¿Qué son las Proteínas?
Las proteínas son biomoléculas orgánicas compuestas por carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N). Generalmente también presentan azufre (S) y ocasionalmente fósforo (P), hierro (Fe), magnesio (Mg), cobre (Cu) y otros elementos en menor proporción.
Las funciones de las proteínas son muy variadas: forman estructuras, se comportan como hormonas o como enzimas, pueden tener función de transporte o participar en las respuestas inmunológicas. Tanto por su abundancia (son las biomoléculas más abundantes) como por su diversidad de tipos y variedad de funciones que realizan, las proteínas tienen una enorme importancia biológica.
En cuanto a su composición, las proteínas están formadas por aminoácidos. Estos aminoácidos se unen entre sí formando péptidos, y el conjunto de péptidos se denomina polipéptido o proteína.
¿Qué son los aminoácidos?
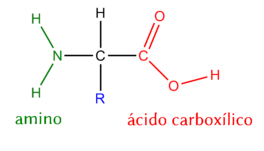
Los aminoácidos son los componentes fundamentales de las proteínas. Estos, tienen una estructura básica que consiste en un carbono central, conocido como carbono alfa (α), al que se unen cuatro grupos distintos: un grupo amino (-NH2), un grupo carboxilo (-COOH), un átomo de hidrógeno (H) y una cadena lateral, denominada grupo R o radical.
La cadena lateral o grupo R varía entre los diferentes aminoácidos y determina las propiedades químicas y físicas específicas de cada uno. Por ejemplo, la cadena lateral puede ser simple como en el caso de la glicina (un solo átomo de hidrógeno) o más compleja como en la triptófano (un anillo indol).
a) Propiedades de los Aminoácidos
Los aminoácidos son generalmente sólidos cristalinos e incoloros. Su solubilidad en agua varía dependiendo de la naturaleza de su cadena lateral. Además, tienen carácter anfótero, lo que significa que pueden actuar tanto como ácidos como bases en una disolución acuosa. Esto, se debe a la capacidad del grupo amino para aceptar protones y del grupo carboxilo para donarlos, lo que es crucial en el mantenimiento del equilibrio ácido-base en los seres vivos.
Otra de las características que poseen los aminoácidos es la estereoisomería. La estereoisomería en los aminoácidos se refiere a la existencia de dos formas isómeras (L y D) debido al carbono asimétrico (carbono alfa). En las proteínas de los seres vivos, predominan los isómeros L.
b) Clasificación de los Aminoácidos
Según la naturaleza de su cadena lateral, los aminoácidos se pueden clasificar en varios grupos: no polares, polares sin carga, ácidos (con carga negativa) y básicos (con carga positiva). Esta clasificación afecta a cómo interactúan entre sí y con su entorno, influyendo en la estructura y función de las proteínas que forman.
c) Enlace Peptídico
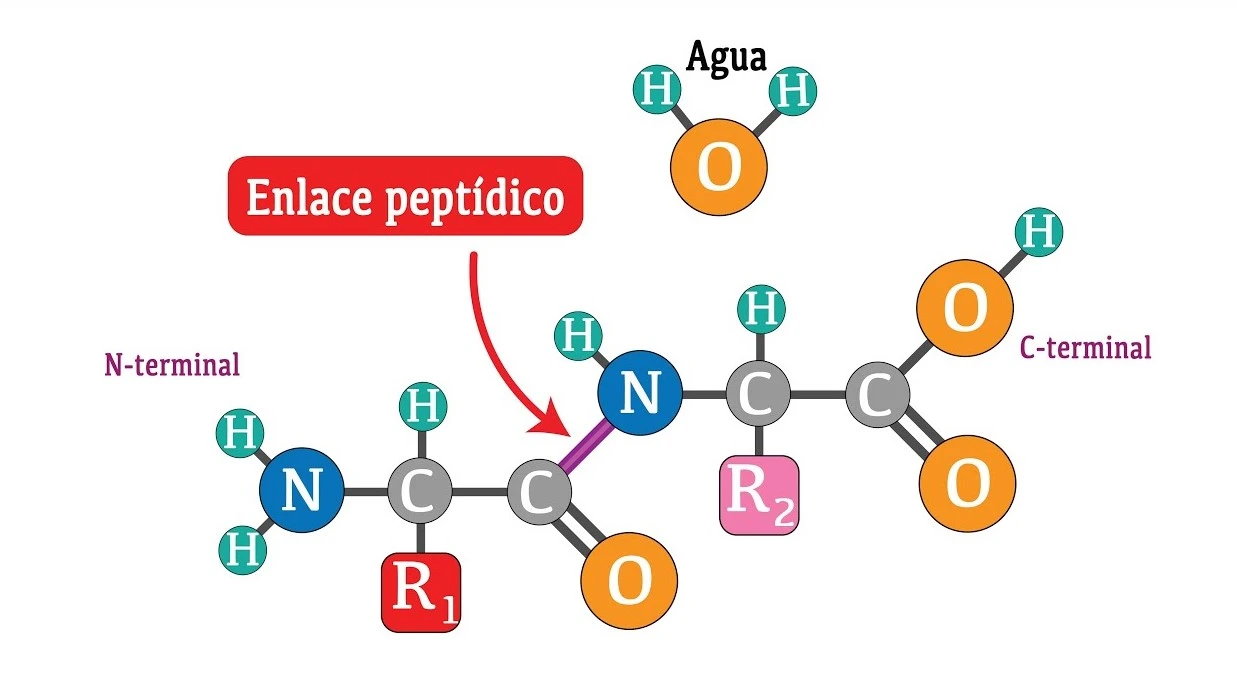
Los aminoácidos se unen entre sí a través de enlaces peptídicos para formar polipéptidos y proteínas. Un enlace peptídico se forma cuando el grupo carboxilo de un aminoácido reacciona con el grupo amino de otro, liberando una molécula de agua (reacción de condensación). Este enlace es un enlace covalente fuerte y juega un papel crucial en la estructura y estabilidad de las proteínas.
Estructura de las proteínas
Una vez realizados los enlaces peptídicos, comienzan a formarse diversas estructuras de estas proteínas. Cada una de estas estructuras recibe un nombre y unas características específicas. Estas, son las siguientes:
a) Estructura Primaria
La estructura primaria de una proteína se refiere a su secuencia lineal de aminoácidos. Esta secuencia está determinada genéticamente y es única para cada proteína. La estructura primaria establece la base para todas las estructuras superiores y funciones de la proteína.
b) Estructura Secundaria
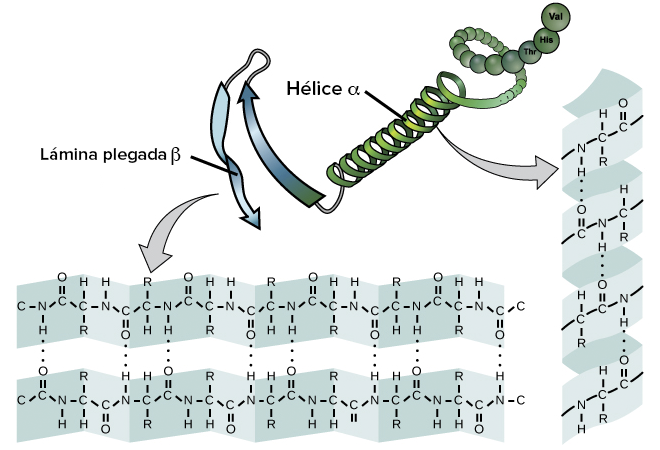
Esta estructura se refiere a la disposición espacial local de la cadena polipeptídica. Las dos formas más comunes son la hélice alfa y la lámina beta.
- Hélice alfa. Es una estructura en espiral donde la cadena de aminoácidos se enrolla alrededor de un eje imaginario. Los enlaces de hidrógeno entre los grupos carboxilo y amino de aminoácidos cercanos estabilizan esta estructura.
- Lámina beta. Se forma cuando las cadenas de aminoácidos se alinean paralelas o antiparalelas entre sí, formando una estructura en forma de «hoja». Está también estabilizada por enlaces de hidrógeno entre cadenas adyacentes.
c) Estructura Terciaria
Esta disposición describe el plegamiento tridimensional completo de una sola cadena polipeptídica. Este plegamiento es crucial para la función de la proteína y está influenciado por interacciones entre las cadenas laterales de los aminoácidos, incluyendo enlaces de hidrógeno, fuerzas de Van der Waals, interacciones hidrofóbicas y puentes disulfuro. La estructura terciaria define la forma y las propiedades funcionales de la proteína.
d) Estructura Cuaternaria
La estructura cuaternaria se presenta en proteínas que consisten en más de una cadena polipeptídica o subunidad. Estas subunidades pueden ser iguales (homoméricas) o diferentes (heteroméricas) y están unidas por interacciones no covalentes y, en algunos casos, por enlaces disulfuro. La estructura cuaternaria es importante para la función de muchas proteínas, como la hemoglobina, que tiene cuatro subunidades que trabajan juntas para transportar oxígeno en la sangre.
Propiedades de las proteínas
Las proteínas, desempeñan una multitud de funciones esenciales en los organismos vivos. Estas complejas estructuras no solo son fundamentales para la construcción y mantenimiento de los tejidos, sino que también actúan como catalizadores de procesos biológicos, transportadores de moléculas y defensores del organismo contra agentes patógenos. Para comprender mejor cómo estas moléculas operan, es crucial entender sus propiedades inherentes. Estas propiedades, que incluyen especificidad, solubilidad, desnaturalización y poder amortiguador, definen la función y el comportamiento de las proteínas en diferentes contextos biológicos.
a) Especificidad. Esta propiedad de las proteínas se refiere a su habilidad única para reconocer y unirse a otras moléculas específicas. Esta propiedad es fundamental para muchas funciones biológicas, como la unión de enzimas a sus sustratos, la unión de anticuerpos a antígenos específicos y la unión de hormonas a sus receptores. La especificidad se determina por la estructura tridimensional de la proteína, especialmente la forma y la química de su sitio activo o de unión.
b) Solubilidad. La solubilidad de una proteína en agua y otros solventes depende de su estructura terciaria y cuaternaria, así como de la naturaleza de sus aminoácidos. Las proteínas con muchas cadenas laterales hidrófilas tienden a ser solubles en medios acuosos, mientras que aquellas con cadenas laterales hidrófobas son más solubles en solventes no polares. La solubilidad de las proteínas es crucial para su función, especialmente para aquellas que actúan en medios acuosos como el plasma sanguíneo o el citoplasma celular.
c) Desnaturalización. Desnaturalización es el proceso por el cual una proteína pierde su estructura tridimensional sin la ruptura de enlaces peptídicos primarios. Esto puede ocurrir debido a cambios en el pH, temperatura, fuerzas iónicas o la presencia de agentes químicos. La desnaturalización resulta en la pérdida de la función biológica de la proteína, ya que su actividad está intrínsecamente ligada a su estructura. En algunos casos, la desnaturalización puede ser reversible, pero en otros, puede ser irreversible.
d) Poder Amortiguador. Las proteínas tienen la capacidad de actuar como amortiguadores (buffers), ayudando a mantener el equilibrio del pH en los fluidos corporales. Esto se debe a su carácter anfótero, lo que significa que pueden actuar tanto como ácidos como bases. Las proteínas, especialmente la albúmina en la sangre, pueden aceptar o donar iones de hidrógeno, lo que les permite resistir cambios en el pH y mantener un ambiente interno estable en el cuerpo.
Clasificación de las Proteínas
Podemos hacer una clasificación atendiendo a la composición de estas mismas. Las proteínas pueden ser:
- Holoproteínas. Son proteínas que están compuestas exclusivamente de aminoácidos. No tienen componentes no proteicos en su estructura. Estas proteínas desempeñan una variedad de funciones dependiendo de su estructura y localización. Ejemplos de holoproteínas incluyen enzimas, algunas hormonas como la insulina y proteínas estructurales como la queratina.
- Heteroproteínas. Además de los aminoácidos, las heteroproteínas contienen un componente no proteico llamado grupo prostético. Este grupo puede ser un metal, un compuesto orgánico o un cofactor vitamínico y es esencial para la función de la proteína. Por ejemplo, la hemoglobina es una heteroproteína cuyo grupo prostético es el grupo hemo, que contiene hierro y es crucial para su capacidad de transportar oxígeno.
Ejemplos de Proteínas y sus Funciones
- Proteínas de Reserva. Almacenan aminoácidos y otros nutrientes. Ejemplos incluyen la ovoalbúmina en los huevos y la caseína en la leche.
- Proteínas Estructurales. Proporcionan soporte y protección estructural. El colágeno y la elastina en los tejidos conectivos, así como la queratina en la piel, pelo y uñas, son ejemplos.
- Proteínas Hormonales. Actúan como mensajeros en el cuerpo. Ejemplos incluyen la insulina, que regula el azúcar en la sangre, y la hormona del crecimiento.
- Proteínas de Transporte. Transportan sustancias en el cuerpo. La hemoglobina transporta oxígeno, y las lipoproteínas transportan lípidos en la sangre.
- Proteínas Defensivas. Incluyen anticuerpos y componentes del sistema inmunológico que protegen contra patógenos.
- Proteínas Contráctiles. Participan en el movimiento y la contracción muscular, como la actina y la miosina en los músculos.
- Proteínas Enzimáticas. Catalizan reacciones bioquímicas. Las enzimas digestivas como la amilasa y la lipasa son ejemplos.
- Proteínas Reguladoras. Regulan procesos celulares y expresión génica. Los factores de transcripción que controlan la transcripción del ADN son un ejemplo.
- Proteínas Homeostáticas. Mantienen el equilibrio fisiológico, como las proteínas que regulan el pH y el equilibrio de fluidos.
Ejercicios sobre Proteínas para preparar Selectividad
1. ¿Qué estructura de la proteína se refiere al plegamiento tridimensional de la cadena polipeptídica?
a) Estructura terciaria
b) Estructura primaria
c) Estructura secundaria
2. ¿Qué estructura de la proteína se forma a partir de la interacción entre varias cadenas polipeptídicas?
a) Estructura primaria
b) Estructura secundaria
c) Estructura cuaternaria
3. ¿Qué nivel de estructura de proteína es afectado durante la desnaturalización?
a) Estructura primaria
b) Estructura cuaternaria
c) Estructura secundaria y terciaria
4. ¿Qué término se utiliza para describir la pérdida de estructura tridimensional de una proteína?
a) Hidrólisis
b) Polimerización
c) Desnaturalización
5. ¿Qué tipo de enlace une los aminoácidos en una proteína?
a) Enlace peptídico
b) Enlace fosfodiéster
c) Enlace glucosídico
Puedes ver más contenidos y apuntes gratuitos de Selectividad y accesos a estudios superiores en nuestra página.
Solución al test: 1a, 2c, 3c, 4c, 5a