¿Qué es un enlace químico?
Un enlace químico es una fuerza de atracción que mantiene unidos a los átomos, iones o moléculas, permitiéndoles formar compuestos químicos más estables. Este proceso implica la interacción entre los electrones de valencia de los átomos, es decir, aquellos que se encuentran en la capa externa y que son responsables de las propiedades químicas de los elementos.
Los enlaces químicos son fundamentales para la química porque determinan la estructura y las propiedades de las sustancias. La formación de un enlace químico resulta en la liberación de energía, lo que hace que el sistema resultante sea más estable que los átomos o moléculas individuales por separado.
Existen varios tipos de enlaces químicos principales, cada uno con características y propiedades únicas:
- Enlaces Iónicos
- Enlaces Covalentes
- Enlaces Metálicos
Además de estos tipos principales, existen interacciones más débiles, como los puentes de hidrógeno y las fuerzas de van der Waals, que aunque no son enlaces químicos en el sentido estricto, juegan roles cruciales en la determinación de las propiedades físicas y químicas de las sustancias.
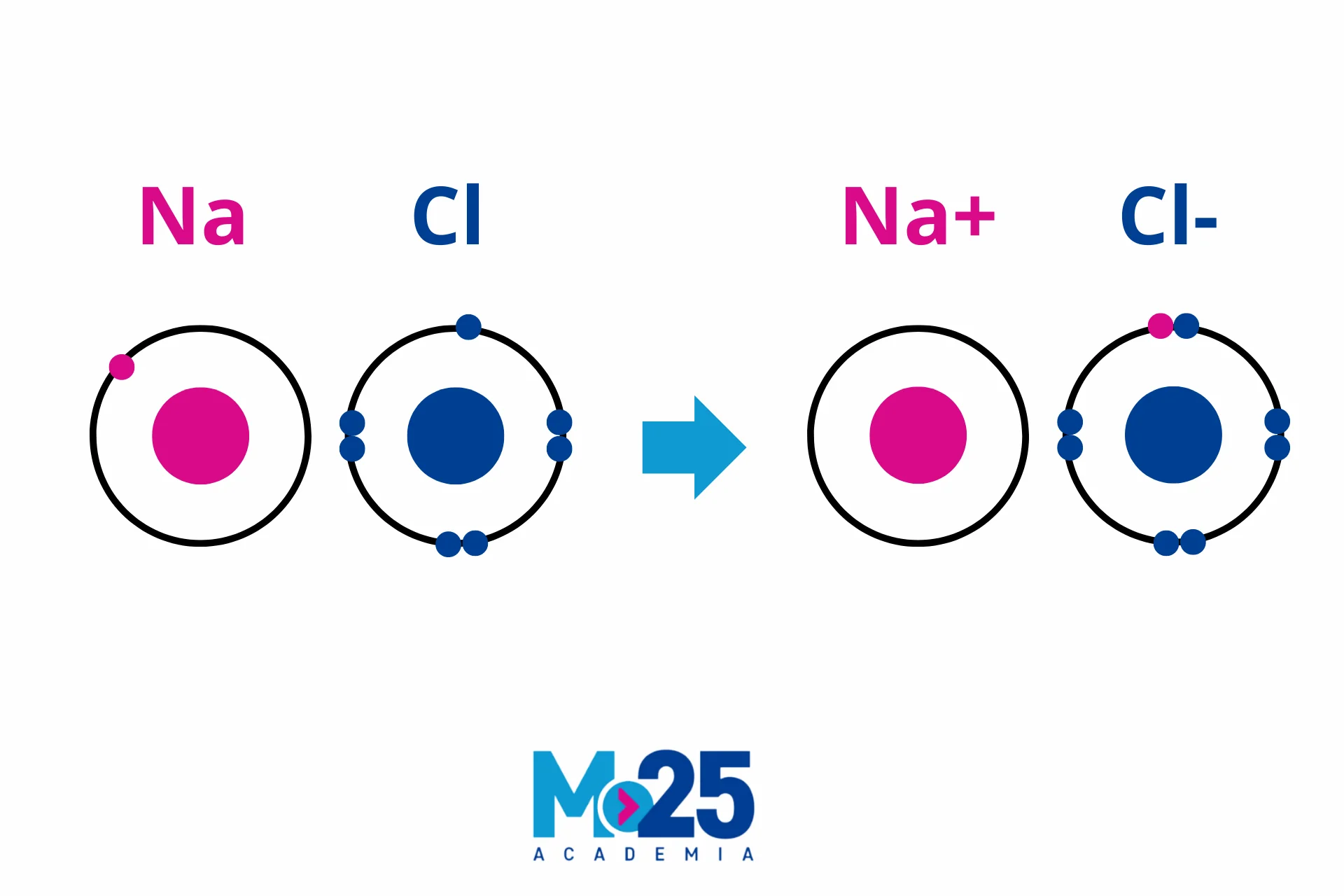
a) Enlaces Iónicos
Definición y Formación. Los enlaces iónicos se forman entre metales y no metales. Estos enlaces ocurren cuando un átomo dona un electrón a otro, lo que lleva a la formación de iones cargados positivamente (cationes) e iones cargados negativamente (aniones). La atracción electrostática entre estos iones de cargas opuestas crea el enlace.
Características:
- Los compuestos iónicos generalmente tienen puntos de fusión y ebullición altos debido a la fuerte atracción entre los iones.
- Suelen ser solubles en agua y otros solventes polares.
- En forma sólida, son buenos aislantes de la electricidad, pero cuando se disuelven en agua o se funden, se convierten en excelentes conductores debido al movimiento de los iones.
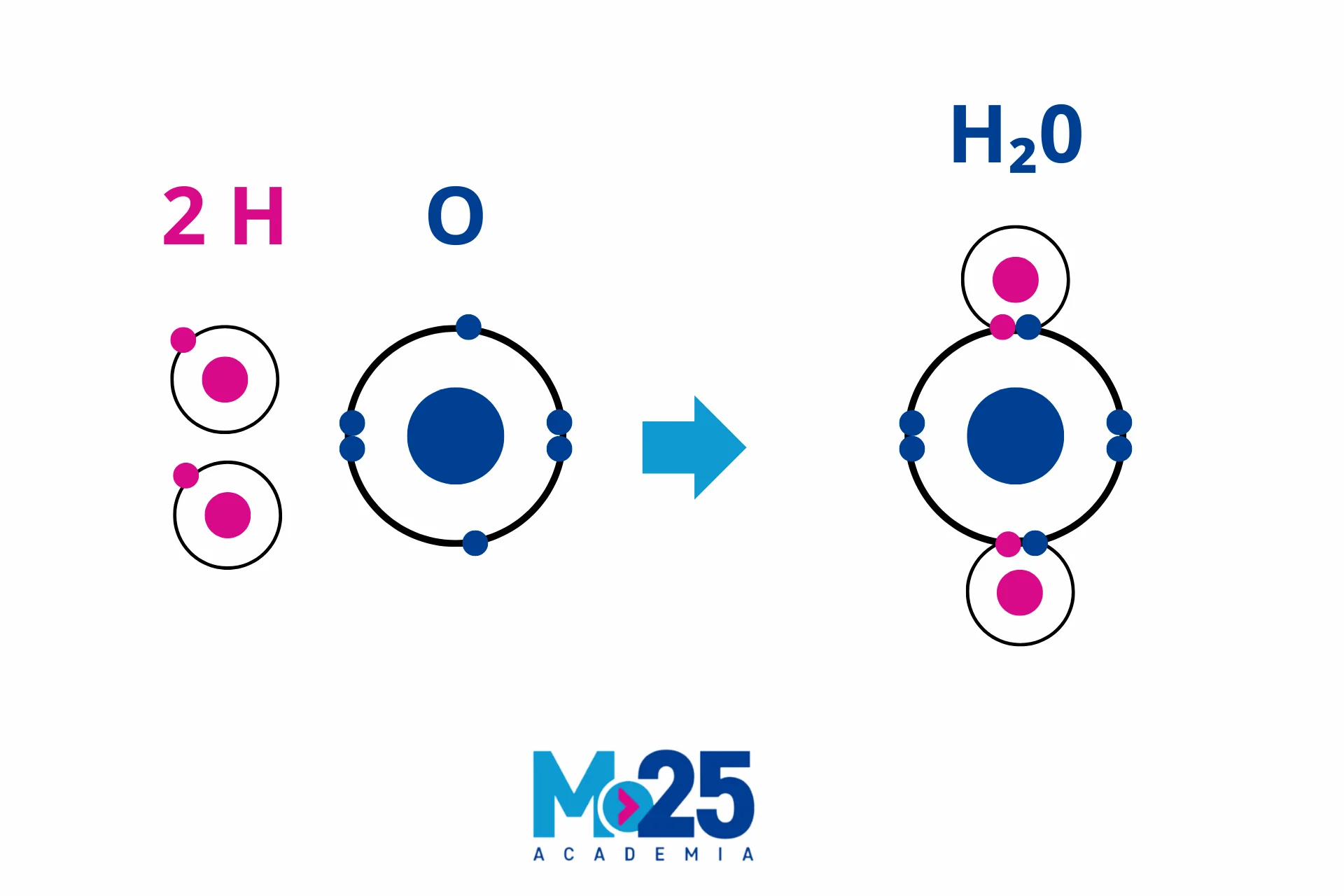
b) Enlaces Covalentes
Definición y Formación. Los enlaces covalentes se forman cuando dos no metales comparten electrones, permitiendo a cada átomo alcanzar una configuración electrónica estable. Este enlace puede implicar el compartir uno, dos o tres pares de electrones, llevando a enlaces simples, dobles y triples, respectivamente.
Características:
- Los compuestos covalentes pueden ser gases, líquidos o sólidos a temperatura ambiente, dependiendo de los elementos involucrados.
- Tienen puntos de fusión y ebullición más bajos en comparación con los compuestos iónicos.
- Estos compuestos no conducen la electricidad ni en estado sólido ni en solución porque no tienen iones libres o electrones.
- La fuerza de los enlaces covalentes puede variar significativamente, siendo los triples enlaces más fuertes que los dobles, que a su vez son más fuertes que los simples.
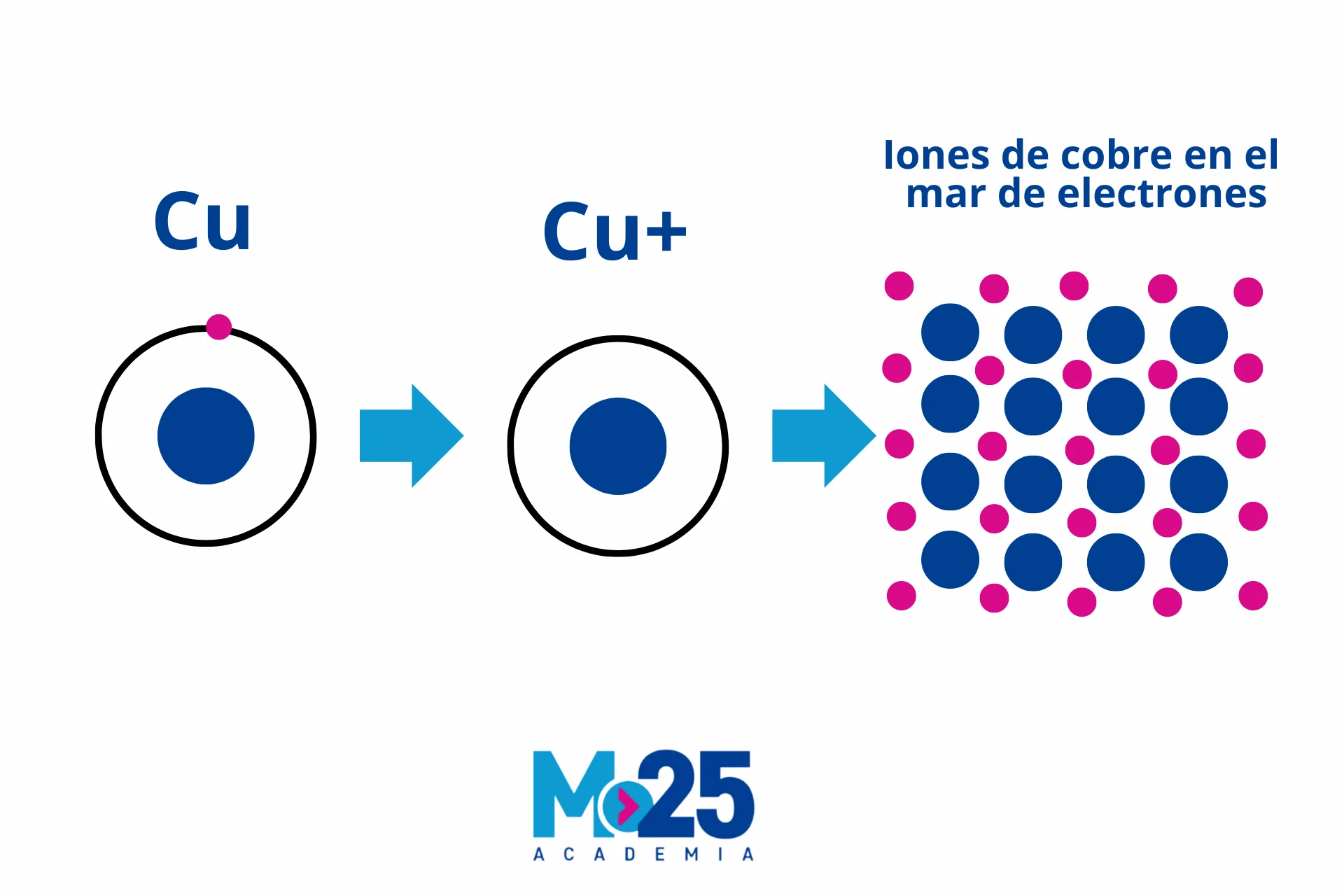
c) Enlaces Metálicos
Definición y Formación. Los enlaces metálicos se encuentran en los metales, donde los átomos comparten libremente sus electrones más externos con muchos otros átomos. Este «mar de electrones» es lo que otorga a los metales sus propiedades distintivas.
Características:
- Los metales son buenos conductores de calor y electricidad porque los electrones pueden moverse libremente.
- Son maleables y dúctiles, lo que significa que pueden ser formados sin romperse.
- Los compuestos metálicos tienen puntos de fusión y ebullición altos, aunque no tan altos como la mayoría de los compuestos iónicos.
- Muestran una amplia gama de dureza y puntos de fusión, desde el mercurio, que es líquido a temperatura ambiente, hasta el wolframio con uno de los puntos de fusión más altos.
d) Enlaces Débiles
- Puentes de Hidrógeno. Son enlaces débiles que se forman cuando el hidrógeno, que está unido covalentemente a un átomo electronegativo (como el oxígeno o el nitrógeno), es atraído por otro átomo electronegativo cercano. Son cruciales para las propiedades del agua y la estructura de las proteínas y el ADN.
- Fuerzas de van der Waals. Incluyen interacciones dipolo-dipolo y fuerzas de dispersión de London, que ocurren debido a fluctuaciones temporales en la distribución de electrones en átomos y moléculas. Aunque son las más débiles de todas las interacciones, son fundamentales para fenómenos como la condensación de gases y la existencia de líquidos y sólidos a bajas temperaturas.
Esquema y tabla comparativa de los tipos de enlaces químicos
| Tipo de Enlace | Formación | Propiedades Principales | Tipo de Sólido (Si aplica) | Ejemplos |
|---|---|---|---|---|
| Iónico | Entre metales y no metales, transferencia de electrones. | Alto punto de fusión y ebullición, solubles en agua, conductores en solución. | Sólido iónico | NaCl (sal de mesa), KBr (bromuro de potasio) |
| Covalente | Entre no metales, compartición de electrones. | Punto de fusión y ebullición variable, no conductores, pueden ser gases, líquidos o sólidos. | Sólido molecular, red covalente, polímeros | H2O (agua), CO2 (dióxido de carbono) |
| Metálico | Entre metales, electrones de valencia compartidos libremente. | Buenos conductores de calor y electricidad, maleables y dúctiles. | Sólido metálico | Fe (hierro), Cu (cobre) |
Preguntas tipo test sobre los tipos de enlaces químicos

Time's up

Time is Up!
Te invitamos a que sigas viendo apuntes gratuitos y ejercicios.